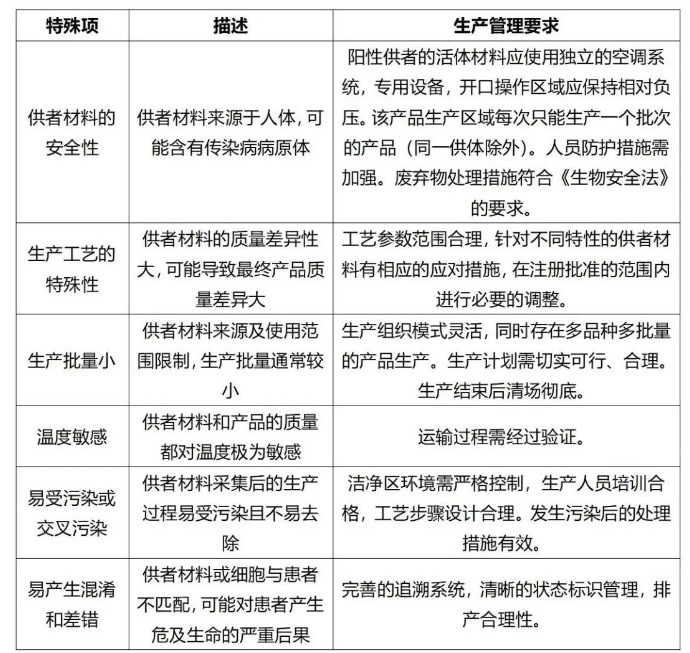
GMP細胞治療產品附錄(征求意見稿)列出的6項細胞產品的特殊性:供者材料的安全性、生產工藝的特殊性、生產批量小、溫度敏感、易受污染或交叉污染、易產生混淆和差錯,基本都對細胞治療產品生產企業(以下簡稱企業)在廠房設計及生產管理策略方面提出了較高的要求。
細胞治療行業的另一大特性是靶點更新快,技術更新快。靶點更新快代表著品種多,技術更新快,代表生產工藝更新換代快。如亙喜生物的FasTCART平臺和TruUCART平臺,可能針對同一把靶點開發不同產品。又比如,針對BCMA和CD19 各自單靶點和雙靶點的產品。企業不可能也沒有必要針對不同靶點,不同工藝專門建生產車間,這就注定產品在制備過程中存在多產品共線的可能性。
結合《藥品生產質量管理規范》、《藥品共線生產質量管理指南》、《藥品生產質量管理規范-細胞治療產品附錄》、《免疫細胞治療產品藥學研究與評價技術指導原則》,細胞治療產品在多產品共線生產的情況下,企業應當考慮的因素以及應該采取的管理措施如下。
細胞治療產品共線情況描述
現目前國內的細胞治療企業,隨著近幾年CDMO企業的興起,MAH制度的提出進一步支持,部分企業僅建立細胞制劑生產線,質粒和病毒均為外購。還有部分企業則分別針對質粒、病毒和細胞制劑建立生產線。無論是企業自身,還是CXO系列公司,產品制備車間主要存在以下情況:
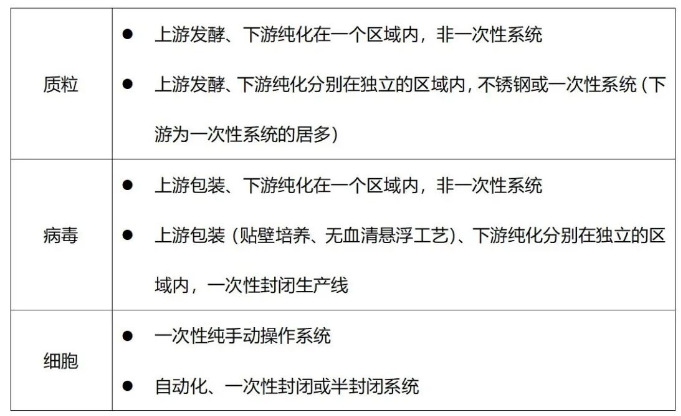
CXO系列公司在生產線的配備上相對完備,針對質粒和病毒分別有一條或多條生產線,部分企業同時配備一條非一次性和多條一次性生產線。盡管如此,也避免不了多產品共線的情況。
比如質粒,目前絕大多數慢病毒包裝采用4質粒系統,1個目的質粒和3個包裝質粒,增加一個靶點需增加一個質粒。病毒也是如此,增加一個靶點就增加一個病毒(品種)。如果在工藝上不存在大的差別,比如均為貼壁工藝或懸浮工藝包裝的慢病毒,大概率會共線生產。細胞制劑也是如此,如果不同靶點之間的工藝差別不大,勢必存在共線生產的情況。
細胞治療產品-多產品共線需考慮的因素
藥品生產中產生污染和交叉污染的途徑主要包括殘留、機械轉移、空氣傳播、混淆。
殘留是交叉污染的主要途徑, 殘留物包括清潔后的設備內表面殘留的物料、產品、 降解產物、清潔劑等。殘留主要針對非一次性使用系統,殘留物需要依靠清潔進行去除,在設備設計、使用、清潔、維護等方面均需要相應的控制措施。殘留在細胞治療產品上則更多考慮質粒的生產、部分病毒載體的生產。
機械轉移包括物料從受污染的非產品接觸表面轉移到產品中的所有可能的途徑,需要在人、機、料、法、環各個方面加強管理,設計合理的人流、物流流向,嚴格的物料管理要求等,尤其在品種轉換方面,對更換品種的順序進行充分評估并明確規定。
空氣傳播是指產品或物料產生穩定的氣溶膠移動至其它產品區域,并在該區域大量沉積在另一個暴露的產品上,導致產品的交叉污染。非封閉性設備容易產生這一類污染,需注重設備設施、廠房設計、空調系統方面的管理。針對一次性系統而言,機械轉移和空氣傳播是產生污染和交叉污染的主要途徑。
細胞治療產品的共線生產不可避免,但確需共線時,還應進行全面考慮。具體考慮因素如下:
01 多產品共線應有相應的評估報告
持有人和藥品生產企業應當按照法律法規要求,綜合考慮藥品的特性、生產過程、預定用途、廠房設施與設備等因素,評估多產品共線生產的可行性,并形成共線生產可行性報告。
02 擬共線品種的特性
品種特性主要包含產品類別、毒性、活性、致敏性、溶解性、活性微生物、性狀、物質狀態等。一般情況下,不同質粒共線、不同病毒載體共線以及不同靶點細胞制劑共線,在溶解性、性狀、物質狀態等理化性質方面基本無差異,而在毒性、活性、致敏性等方面,細胞制劑可能存在輕微差別。
03 生產工藝的特性
質粒、病毒載體和細胞制劑均可視作非最終滅菌制劑,一般可進行共線生產的品種,在生產工藝上的差別也較小。比如細胞制劑一次性純手動生產工藝和自動化全封閉工藝則相對較難實現共線生產。一方面,生產設備大,手動生產主要生產設備為生物安全柜、二氧化碳培養箱、離心機等,自動化封閉生產工藝主要生產設備為Sepax C-Pro、Xuri(WAVE)等。此外,生產環境潔凈度要求也有所不同,純手動生產需在B+A環境下,半封閉設備在C級環境下,全封閉設備則可在D級環境即可。
04 預定用途
質粒和病毒在給藥途徑、臨床適應癥、用藥禁忌配伍禁忌及聯合用藥情況、用藥對象、劑量、是否長期用藥等方面差異均較小。細胞制劑的給藥途徑基本一致,目前基本都為一次性給藥,也不存在長期用藥的情況。
05 廠房設施設備共用情況
如前文描述,根據實際共線情況進行具體分析。如過采用的非一次性系統,比如質粒發酵為不銹鋼發酵罐,則需重點考慮設備的清潔驗證。如所有設備均采用一次性系統,則應重點考慮一次性拋棄系統需確認密閉性,空調凈化系統如風管、過濾器等的處理措施,設備狀態標識信息等。
06 不同藥物不同階段共線
臨床試驗中的試驗藥物其藥理毒理信息可能尚不全面和充分,與商業化藥品共線生產時,存在未知風險。因此早期臨床試驗用藥物的生產盡可能使用專用或獨立的生產設施設備、一次性生產系統或采用階段性生產、清潔確認相結合方式;臨床試驗用藥物和其他臨床試驗用藥物共線生產時, 在對臨床試驗用藥物特性基本了解的基礎上,采取必要的預防措施,如階段性生產、一次性生產系統等方式,避免臨床試驗用藥物相互之間的污染和交叉污染,確保共線生產產品的安全性,且每批臨床試驗用藥物生產結束后需進行清潔效果確認。
07 生物安全性
考慮新引入物料、產品是否帶來生物安全性風險,如TSE/BSE聲明、菌毒種污染等。
08 活體物質
在細胞產品制備的各個環節均存在活體物質,且生產條件均有利于微生物的繁殖。因此,如果環境清潔不徹底,產生污染風險的可能性極大。同時,如果上批次生產后清潔不徹底,活性物質也存在引起的交叉污染的風險。比如上批生產A質粒的菌種混入下批生產B質粒的菌種中。活體物質易繁殖或復制,生產后應滅活和清潔,滅活和清潔的效果應當經過確認。
09 清潔程序
生物制品的清潔程序通常為強酸堿或高溫(60~80℃),該條件下蛋白易變性或降解,此類情況可找其它具有代表性的參數進行確認。
細胞治療產品-多產品共線可以采取的管理措施
01 采用階段性生產方式
質粒生產避免在同一空間內同時生產兩種質粒,一條生產線一次只能生產一種病毒,一個空間一次也只能生產一種病毒,同一個空間盡可能每次只生產一個細胞批次(如使用密閉系統進行細胞培養的情況除外)。
02 采用一次性密閉系統生產
同一生產操作間內有多個隔離器,應當定期對其進行完整性檢查,隔離器不應直接向操作間內排風,且排風不可循環利用。還應采取有效的措施避免物料、產品和廢棄物的差錯和混淆,如密封轉移、交替操作、定置管理、滅菌與消毒以及單向流傳遞等。
同一生產區域內采用密閉系統進行同一品種不同批次細胞產品生產的,除細胞培養步驟外應避免在同一生產操作間內同時進行多個相同或不同步驟的生產操作,在完成一個步驟生產操作后應及時進行清場。
03 清潔方法經過驗證(包括廠房和設備的清潔)
采用經過驗證或已知有效的清潔和去污染操作規程進行設備清潔;必要時,應當對與物料直接接觸的設備表面的殘留物進行檢測。每次生產結束后需進行清場,生產結束后的環境清潔應當考慮對空調系統如風管、過濾器等的處理措施,采用經驗證的標準程序進行清潔及消毒處理。每次生產操作前,對清場情況進行確認。
04 有效的預防措施
采用密閉系統進行細胞培養,同一生產操作間或同一培養箱內可同時培養和保存不同批次產品,但應當采取有效措施避免混淆;采用非密閉系統進行細胞培養,應對培養箱內不同批次產品進行物理隔離(如采用蜂巢式培養箱)或采用不同生產操作間的獨立培養箱,培養箱內應保持一定的潔凈度且可以進行消毒或滅菌。還應進行充分的風險評估,采取有效措施以避免交叉污染和混淆;
同一生產區域內的多個生物安全柜,分布于不同生產操作間,宜采用密閉系統同時進行同一品種不同批次細胞產品的生產;如無法保證全部生產過程的密閉控制,則應充分進行風險評估,并采取有效的措施避免物料、產品和廢棄物的差錯和混淆,如密封轉移、房間壓差控制、不得跨越房間操作、人員不得交叉走動、滅菌與消毒以及單向流傳遞等;
密閉系統或設備發生意外開啟或泄漏的,應當進行風險評估并采取有效的應急措施。
05 可追溯性
確保生產全過程樣品和生產物料(包括從細胞/組織采集過程、生產、運輸到臨床應用整個過程)的可追溯性。
06 陽性供體的活體材料
應使用獨立的空調系統,專用設備,開口操作區域應保持相對負壓。該產品生產區域每次只能生產一個批次的產品(同一供體除外)。
含有傳染病病原體的自體供者材料,在生產、轉運過程中不得接觸其它不含有傳染病病原體的供者材料或細胞產品。
(來源:蒲公英)