在高度監(jiān)管的生物制藥行業(yè)中,數(shù)據(jù)完整性(DI) 對于確保滿足產(chǎn)品規(guī)格的決策是準(zhǔn)確的、進(jìn)而確保患者安全和產(chǎn)品質(zhì)量至關(guān)重要。隨著行業(yè)越來越多地采用過程分析技術(shù)(PAT)、高級自動化、高通量微觀研究以及管理由機器學(xué)習(xí)(ML) 工具創(chuàng)建的數(shù)據(jù)模型,確保該領(lǐng)域內(nèi)DI 的挑戰(zhàn)變得越來越復(fù)雜。本文旨在確定隨著行業(yè)向工業(yè)4.0 邁進(jìn),生物制藥生產(chǎn)設(shè)施中的 DI 風(fēng)險和緩解策略。為實現(xiàn)這一目標(biāo),本文總結(jié)了常見的 DI 違規(guī)行為,并將其與 FDA、EMA和 MHRA 使用的 ALCOA+ 原則聯(lián)系起來。文章還討論了ISPE GAMP5 和 ISA-95 標(biāo)準(zhǔn)中的相關(guān) DI 指南,重點關(guān)注經(jīng)過驗證的計算機化和自動化生產(chǎn)系統(tǒng)在避免DI 風(fēng)險和生成合規(guī)數(shù)據(jù)方面的作用。文章還強調(diào)了DI 在使用數(shù)據(jù)分析、以確保開發(fā)的模型滿足過程監(jiān)控所需的監(jiān)管標(biāo)準(zhǔn)時的重要性。這包括討論可能的緩解策略和方法,以確保針對智能生產(chǎn)運營維護(hù)數(shù)據(jù)完整性,例如使用云平臺來促進(jìn)生產(chǎn)數(shù)據(jù)的存儲和傳輸,以及擺脫紙質(zhì)記錄。
產(chǎn)品質(zhì)量、安全性和有效性是生物制藥行業(yè)在生產(chǎn)治療藥物時的主要關(guān)注點。通過臨床試驗和工藝開發(fā)來證明這些品質(zhì),最終獲得上市許可可能需要十多年的時間。監(jiān)管機構(gòu)需要審查大量數(shù)據(jù),以確保良好生產(chǎn)規(guī)范(GMP) 工藝的穩(wěn)健設(shè)計能夠始終如一地為患者提供高質(zhì)量、有效和安全的產(chǎn)品。監(jiān)管機構(gòu)希望所有產(chǎn)品質(zhì)量結(jié)果也符合必要的數(shù)據(jù)完整性(DI) 標(biāo)準(zhǔn)。高通量平臺和過程分析技術(shù) (PAT) 等先進(jìn)技術(shù)有助于更好地監(jiān)控和控制過程,最終確保提高產(chǎn)品質(zhì)量。這些最近的創(chuàng)新技術(shù)顯著增加了生產(chǎn)過程中生成的數(shù)據(jù)的數(shù)量和復(fù)雜性。數(shù)據(jù)復(fù)雜性的上升促使人們轉(zhuǎn)向使用更復(fù)雜的方法來協(xié)助決策,例如使用統(tǒng)計預(yù)測模型。從如此復(fù)雜的數(shù)據(jù)包中提取信息的需求進(jìn)一步突顯了DI 在生物工藝中的重要性。DI 也是工業(yè) 4.0 成功不可或缺的一部分,工業(yè)4.0 描述了集成自主實時監(jiān)測和控制、以提高響應(yīng)能力和靈活性的智能未來工廠。工業(yè)4.0 依賴于對數(shù)據(jù)管理基礎(chǔ)設(shè)施的更多投資,例如數(shù)據(jù)湖或數(shù)據(jù)倉庫,這些基礎(chǔ)設(shè)施能夠?qū)崿F(xiàn)有效的數(shù)據(jù)存儲和傳輸,以促進(jìn)信息的傳播。本文將討論DI 的重要性,以及如何減輕遵循當(dāng)前良好生產(chǎn)規(guī)范(cGMP) 的生物生產(chǎn)過程中的任何潛在 DI 風(fēng)險。
DI標(biāo)準(zhǔn)
DI 被定義為滿足完整性、準(zhǔn)確性和一致性標(biāo)準(zhǔn)的數(shù)據(jù)。更具體地說,2013年 FDA 引入了 ALCOA 的首字母縮寫詞,以表明數(shù)據(jù)必須是可歸屬的(attributable)、清晰的(legible)、同時的(contemporaneous)、原始的(original)和準(zhǔn)確的(accurate),此外還要具有持久性和可用性,這通常被稱為 ALCOA+。圖 1 總結(jié)并描述了每個ALCOA+ 元素,以確保數(shù)據(jù)處理期間的數(shù)據(jù)穩(wěn)健性和可訪問性,幫助加強對產(chǎn)品應(yīng)用的監(jiān)管審批。實施ALCOA+ 可以幫助檢測 DI 風(fēng)險并避免危及或延遲監(jiān)管產(chǎn)品批準(zhǔn),從而導(dǎo)致工藝時間和材料的損失;因此,ALCOA+ 最終可以節(jié)省成本。
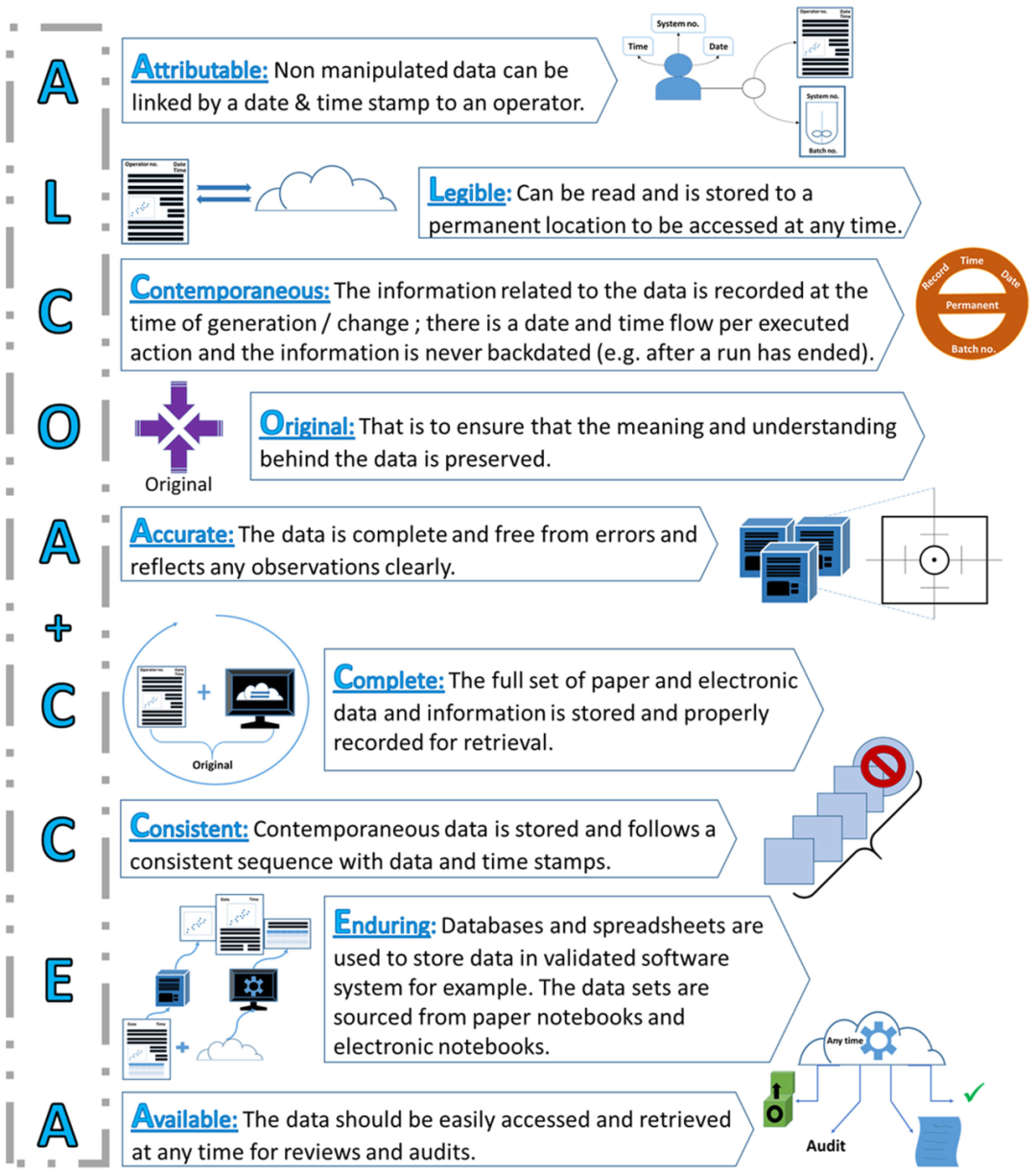
圖1. FDA 的 ALCOA+ 原則及其分解要素描述
DI 法規(guī)和違規(guī)行為
近年來,監(jiān)管警告信有所增加,其中43% 涉及可能危及公司監(jiān)管地位的 DI 問題。除了 ALCOA+ 原則外,F(xiàn)DA、EMA 和MHRA 等監(jiān)管機構(gòu)也提出了更大的要求,并更新了針對DI 合規(guī)性的審查和有關(guān)該主題的最新指南。表 1總結(jié)了從上述監(jiān)管機構(gòu)整理的主要 DI 指南以及在這些情況下違反 DI 和不遵守ALCOA+ 原則的常見示例。指南涵蓋了從培訓(xùn)員工數(shù)據(jù)處理到檢查內(nèi)部審計跟蹤和驗證控制策略的主題。常見的DI 違規(guī)通常與數(shù)據(jù)操縱和偽造有關(guān)。示例包括由于培訓(xùn)不足而導(dǎo)致記錄不完整的文檔,例如,由于審計追蹤不足而回溯批次記錄,以及故意偽造記錄以創(chuàng)建符合目標(biāo)規(guī)范的可接受結(jié)果。例如,2018年,一家亞洲工廠因 HPLC 數(shù)據(jù)不符合規(guī)范而被警告不遵守 cGMP 生產(chǎn)法規(guī),并且重新測試了數(shù)據(jù),但沒有明確說明之前的結(jié)果為何不符合規(guī)范而導(dǎo)致 DI 違規(guī)。這突出了合理的科學(xué)判斷的重要性,以證明對受限數(shù)據(jù)的更改是合理的,并遵守正式文件的規(guī)定,以記錄和修改程序。
生產(chǎn)系統(tǒng)和 DI - 風(fēng)險和緩解措施
計算機化系統(tǒng)由控制系統(tǒng)(即硬件、軟件和固件)和網(wǎng)絡(luò)組件組成,其有助于控制過程,例如創(chuàng)建、修改和共享數(shù)字信息。控制系統(tǒng)國際標(biāo)準(zhǔn)(ISA-95) 旨在定義生產(chǎn)控制功能和其它企業(yè)功能之間交換的電子信息。圖 2通過疊加 GxP 生物工藝數(shù)據(jù)(即 GLP、GMP和 GDP,其中 x = 分別為實驗室、生產(chǎn)和文檔)和用于監(jiān)測和控制生物反應(yīng)器的儀器的當(dāng)前示例來說明ISA-95 級別。0 級描述了生產(chǎn)環(huán)境中的物理生產(chǎn)過程。1 級記錄來自傳感器或PAT 工具等儀器的過程數(shù)據(jù)。這些儀器在生物工藝中捕獲的典型數(shù)據(jù)包括在線(例如,pH或拉曼)、離線(例如,滴度)、產(chǎn)品質(zhì)量(例如,聚體)和元數(shù)據(jù)(例如,批號)。記錄的數(shù)據(jù)輸入到第 2級中看到的實時過程監(jiān)測和控制。這輸入到關(guān)于運營生產(chǎn)的第 3級,例如使用生產(chǎn)執(zhí)行系統(tǒng) (MES)。最后,業(yè)務(wù)計劃級別(第 4 級)概述了可用資金以及系統(tǒng)和設(shè)備的管理,這些系統(tǒng)和設(shè)備旨在在設(shè)定的時間范圍內(nèi)為患者生產(chǎn)高質(zhì)量的產(chǎn)品。
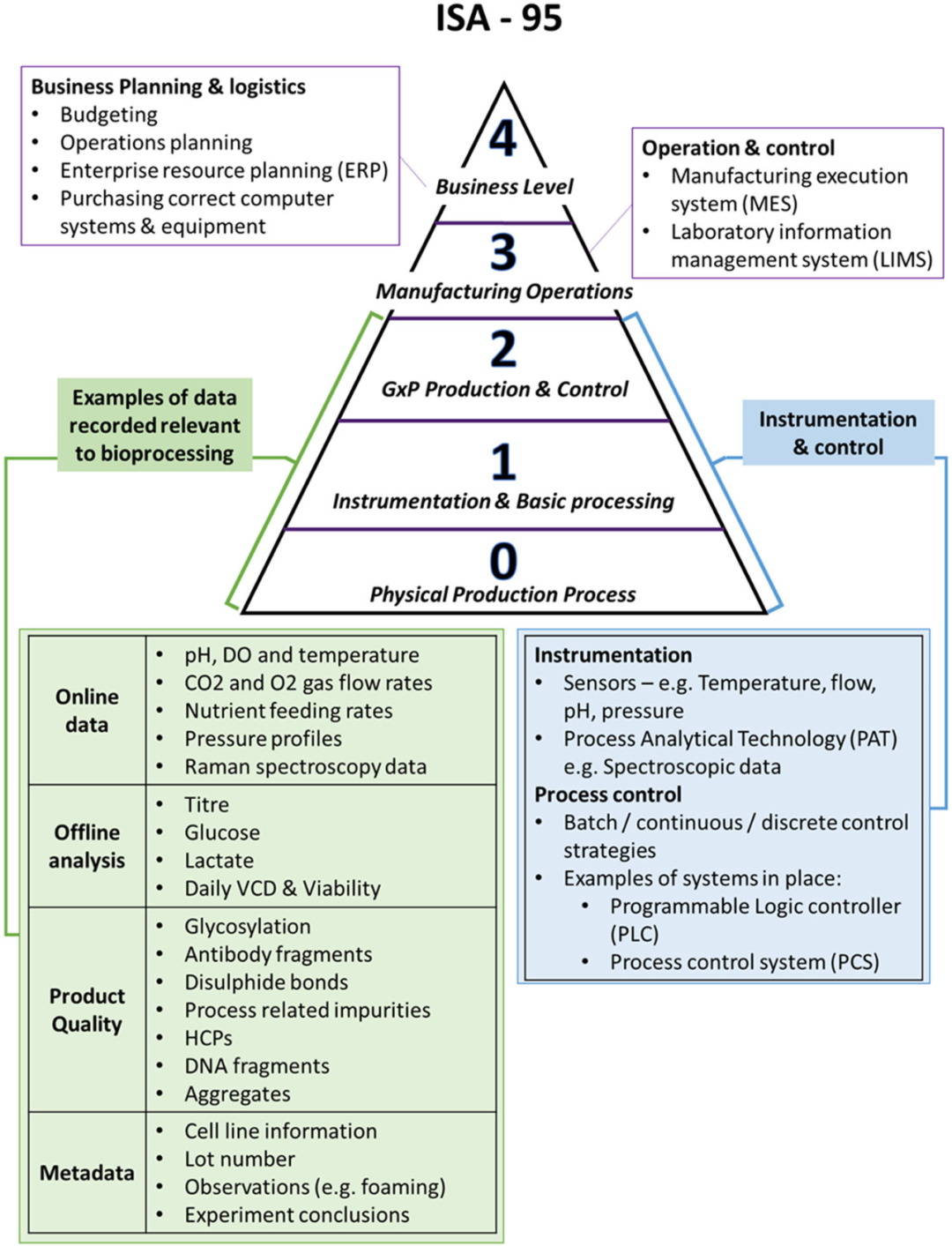
圖2. ISA-95 五層框架,用于與 GMP 生物工藝生產(chǎn)相關(guān)的計算機化系統(tǒng),并附有在每個相應(yīng)層下描述的示例列表。
計算機化系統(tǒng)帶來了一些 DI 挑戰(zhàn),但是,問題通常源于對復(fù)雜數(shù)據(jù)記錄(例如 PAT 記錄)的不當(dāng)管理以及未能驗證使用中的系統(tǒng)。隨著生物制藥生產(chǎn)設(shè)施使用更多的計算機化系統(tǒng),需要從傳統(tǒng)的紙質(zhì)方法轉(zhuǎn)變?yōu)橥耆娮踊南到y(tǒng),以減輕與容易出錯的任務(wù)(例如手動pH 記錄)相關(guān)的風(fēng)險并簡化文檔。為了生成符合DI 的數(shù)據(jù),必須對軟件進(jìn)行質(zhì)量檢查,以在將其應(yīng)用于GxP 環(huán)境之前驗證和確認(rèn)控制策略的預(yù)期用途。減少DI 問題的另一種方法是通過頻繁的內(nèi)部審計和記錄審查(例如,系統(tǒng)日志),它可以識別不符合DI 的區(qū)域并啟用緩解措施。擁有強大的IT 基礎(chǔ)架構(gòu)有助于簡化數(shù)據(jù)審查流程并有效管理數(shù)據(jù)存儲、傳輸和備份。因此,缺乏強大的基礎(chǔ)架構(gòu)會給生產(chǎn)流程的連續(xù)性以及最終產(chǎn)品的成功帶來風(fēng)險,如果系統(tǒng)出現(xiàn)故障的話。
因此,需建立良好的自動化生產(chǎn)規(guī)范(GAMP),以提供一種基于風(fēng)險的方法,從而在工業(yè)中實現(xiàn)合規(guī)的GxP 計算機化系統(tǒng),其中包括滿足 DI 法規(guī)。GAMP5(2008年更新)與 ISA-95 一起可以幫助科學(xué)家和工程師生成數(shù)據(jù)和系統(tǒng)并與之交互。更多文件,如 GAMP 的 “2020 DI by design” 和2017 DI 指南也已發(fā)布,以提供進(jìn)一步理解并制定更好的與DI 風(fēng)險相關(guān)的緩解策略。總的來說,這些指南清楚地表明需要經(jīng)過驗證的系統(tǒng)來生成過程監(jiān)控所需的合規(guī)數(shù)據(jù),此外還需要針對手動和電子表單進(jìn)行GDP 培訓(xùn)。GxP 流程培訓(xùn)必須包含全面的解釋以及與法規(guī)的鏈接,以創(chuàng)建披露和避免 DI 問題的公司文化,例如,使用經(jīng)過驗證的表格和模板。還必須向操作員提供文件,例如標(biāo)準(zhǔn)操作程序(SOP),以確保執(zhí)行一致的方法、適當(dāng)管理數(shù)據(jù)并降低DI 風(fēng)險。這些指南允許科學(xué)家和質(zhì)量人員通過創(chuàng)建原型、規(guī)范和行動計劃來提高標(biāo)準(zhǔn)化,從而加快快速有效的問題解決和支持。
工藝設(shè)施由從不同供應(yīng)商購買并在不同規(guī)模上工作的各種計算機化系統(tǒng)組成。因此,使用的不同分析系統(tǒng)將存儲和生成不同格式的數(shù)據(jù),例如CSV 和 txt 文件。使用多種不一致的數(shù)據(jù)格式是該行業(yè)的主要限制,需要做更多的工作來標(biāo)準(zhǔn)化這些數(shù)據(jù)格式。為了分析這些數(shù)據(jù)集,需要進(jìn)行預(yù)處理和操作,以產(chǎn)生分析師可讀的結(jié)果。Allotrope Foundation 提供了一種解決方案,該解決方案使用標(biāo)準(zhǔn)數(shù)據(jù)框架,便于將分析數(shù)據(jù)存儲、使用和集成到單個文件中,而不管數(shù)據(jù)復(fù)雜性如何,以幫助避免數(shù)據(jù)丟失和誤解風(fēng)險。此類數(shù)據(jù)框架還提供元數(shù)據(jù)的集成和可追溯性(例如,細(xì)胞接種液、細(xì)胞類型和起泡問題),可以提供必要的數(shù)據(jù)背景。記錄元數(shù)據(jù)至關(guān)重要,因為它捕捉了實驗的本質(zhì)和目的,簡化了分析,并有助于利用對更好的過程控制和產(chǎn)品質(zhì)量保證所必需的更深入的理解。
工業(yè) 4.0 - 數(shù)據(jù)分析和智能生產(chǎn)解決方案對 DI 的影響
自動化和數(shù)字化正在推動由工業(yè) 4.0 管理的智能生產(chǎn)解決方案。這些需要持久的計算機化系統(tǒng)來繼續(xù)生產(chǎn)高效、優(yōu)質(zhì)的治療藥物。高級PAT 使用的增加進(jìn)一步增加了生成的多維數(shù)據(jù)的復(fù)雜性和數(shù)量,這需要額外的處理、模型生成和存儲。因此,越來越需要使用機器學(xué)習(xí)(ML) 等建模工具,包括多變量數(shù)據(jù)分析 (MVDA)、機械模型和混合建模技術(shù),以利用來自這些數(shù)據(jù)的洞察力。同樣,所有處理的數(shù)據(jù)分析模型和數(shù)據(jù)包都必須符合DI 標(biāo)準(zhǔn)。生成的數(shù)據(jù)要么以未經(jīng)編輯的原始形式記錄,例如原始CSV 文件,要么以經(jīng)過處理的形式記錄,例如通過模型重組和擬合的數(shù)據(jù)。重要的是要注意原始數(shù)據(jù)必須始終安全存檔,并在驗證期間提供給監(jiān)管機構(gòu)檢查,以確保符合DI 標(biāo)準(zhǔn)。因此,存儲、傳輸和處理的數(shù)據(jù)和方法必須經(jīng)過驗證和記錄,以確保數(shù)據(jù)的準(zhǔn)確性和完整性得以保留。將PAT 工具與先進(jìn)的 ML 技術(shù)結(jié)合使用,可用于提取隱藏信息并獲得進(jìn)一步的理解,用于更好的監(jiān)控和控制。FDA 鼓勵實施這些創(chuàng)新工具,并允許以可比性方案提交 PAT 數(shù)據(jù),以驗證工藝實施策略和時間表。同樣,可以實施旨在識別、調(diào)查和了解過程偏差等問題的根本原因的糾正和預(yù)防措施(CAPA) 的監(jiān)管概念,以防止再次發(fā)生。GMP 環(huán)境將受益于集成 CAPA 程序,以預(yù)測哪些過程可能會受到影響,并導(dǎo)致代價高昂的延誤或更嚴(yán)重的產(chǎn)品報廢。
數(shù)據(jù)分析可用于通過 ML 工具和高級數(shù)據(jù)分析來預(yù)測新出現(xiàn)的問題,以估計和推薦適當(dāng)?shù)慕鉀Q方案,但確保處理的數(shù)據(jù)符合DI 標(biāo)準(zhǔn)至關(guān)重要。數(shù)據(jù)分析還有可能減少偏差和失敗的批次運行,最終改善過程控制并縮短開發(fā)時間。因此,在GMP 級別使用數(shù)據(jù)分析必須由在早期階段開發(fā)和驗證的模型管理,這些模型也符合商業(yè)GMP 生產(chǎn)的 DI 標(biāo)準(zhǔn)。需要在開發(fā)的早期階段確保滿足 DI 標(biāo)準(zhǔn)并在整個擴大活動中保持,以最大限度地減少 GMP 環(huán)境中的進(jìn)一步 DI 風(fēng)險。GMP數(shù)據(jù)分析的一個挑戰(zhàn)是記錄的數(shù)據(jù)類型,例如,從在線pH 或 DO 傳感器生成的時間序列數(shù)據(jù)代表一種高頻數(shù)據(jù)采集形式;這通常需要復(fù)雜的動態(tài)模型來提取有用的相關(guān)性。因此,確保這些復(fù)雜的數(shù)據(jù)包符合DI 標(biāo)準(zhǔn)尤為重要。數(shù)據(jù)驅(qū)動的智能生產(chǎn)可以幫助實現(xiàn)覆蓋不同生產(chǎn)站點的有效數(shù)據(jù)和資源管理。云平臺等智能生產(chǎn)解決方案可以提高安全性和可訪問性,將大量復(fù)雜數(shù)據(jù)安全地存儲和傳輸?shù)絾蝹€服務(wù)器上,從而在整個處理過程中保留其DI。例如,基于云的 ELN 改進(jìn)了實驗物流工作流程,并且與管理手動日志的價格范圍相同。然而,這需要一個復(fù)雜的內(nèi)置基礎(chǔ)設(shè)施來促進(jìn)安全的內(nèi)部網(wǎng)和外部網(wǎng)等功能,此外還需要安全的互聯(lián)網(wǎng)連接,以與受信任的云提供商進(jìn)行通信。使用云平臺會帶來與數(shù)據(jù)傳輸、數(shù)據(jù)所有權(quán)和訪問權(quán)的相關(guān)風(fēng)險,特別是在全球化生物制藥公司在不同國家擁有多個站點的情況下,這些公司可能受不同的數(shù)據(jù)合規(guī)性法規(guī)的約束。防止數(shù)據(jù)和系統(tǒng)盜竊的一種方法是設(shè)置適當(dāng)?shù)木W(wǎng)絡(luò)安全措施,以防止黑客攻擊和數(shù)據(jù)盜竊。這對于在家工作的人提供更多遠(yuǎn)程訪問至關(guān)重要,因此需要兩點身份驗證,以確保在用戶和數(shù)據(jù)源之間建立安全連接。最重要的是,智能生產(chǎn)面臨的挑戰(zhàn)是快速和安全的網(wǎng)絡(luò)連接的可用性,以實現(xiàn)所需的短延遲時間,以提供實時監(jiān)控功能。這一點至關(guān)重要,因為需要立即訪問存儲在云中的數(shù)據(jù),以進(jìn)行有效的實時監(jiān)控。圖 3總結(jié)并說明了上述工業(yè) 4.0 中滿足特定于生物反應(yīng)器的 DI 標(biāo)準(zhǔn)的解決方案。生物反應(yīng)器應(yīng)配備經(jīng)過驗證和確認(rèn)的軟件、固件和控制策略。此外,還需要SOP,例如校準(zhǔn)探頭和運行維護(hù),以滿足適合過程監(jiān)測和控制的合規(guī)性要求。捕獲的所有數(shù)據(jù),例如標(biāo)準(zhǔn)傳感器測量值(例如,pH和 DO)、離線分析和其它高級 PAT 傳感器數(shù)據(jù)(例如,來自拉曼光譜)都以未經(jīng)編輯的原始形式記錄和存儲。然后使用數(shù)據(jù)分析對原始數(shù)據(jù)的副本進(jìn)行預(yù)處理和處理,例如在研發(fā)期間開發(fā)并驗證用于大規(guī)模監(jiān)測和控制的ML 工具,然后將其部署在 GMP 生產(chǎn)環(huán)境中。確保記錄所有數(shù)據(jù)和模型操作是關(guān)鍵。為確保生物反應(yīng)器運行期間和運行后的DI 合規(guī)性,必須適當(dāng)存儲頻繁的內(nèi)部審計和記錄的錯誤記錄。一旦數(shù)據(jù)被存儲和歸檔,就可以通過實時監(jiān)測和控制策略執(zhí)行在線分析,從而實現(xiàn)智能生產(chǎn)。
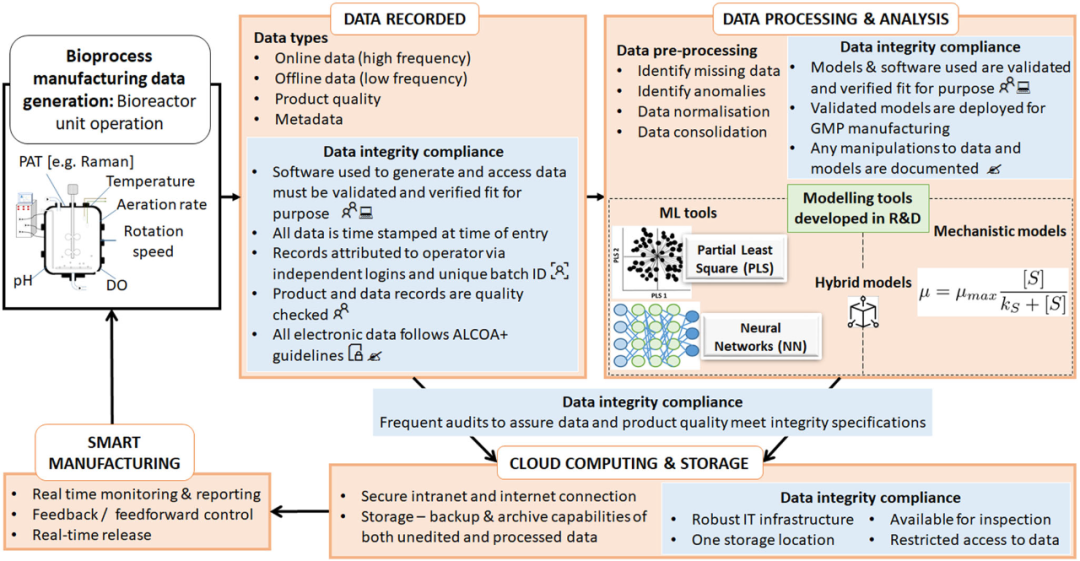
圖3.在特定于生物反應(yīng)器的數(shù)據(jù)生命周期中,確保工業(yè) 4.0 生物工藝中數(shù)據(jù)完整性所需的必要步驟。這包括使用智能生產(chǎn)方法記錄、處理和產(chǎn)生生物過程監(jiān)測和控制的合規(guī)結(jié)果的先進(jìn)技術(shù)。
降低 DI 風(fēng)險的未來措施
隨著生物制藥行業(yè)在數(shù)字化方面變得更加成熟并邁向工業(yè)4.0,考慮采取進(jìn)一步措施降低 DI 風(fēng)險至關(guān)重要。建議使用獨立登錄作為識別簽名,即使是在共享系統(tǒng)上,也可以在監(jiān)管審計期間使數(shù)據(jù)具有歸屬性和可追溯性。未來的解決方案還考慮了區(qū)塊鏈應(yīng)用,它依賴于對生成的數(shù)據(jù)進(jìn)行多步驗證,以確保數(shù)據(jù)的可追溯性、透明度和安全性。這種方法是一種安全的設(shè)計方法,允許將生產(chǎn)數(shù)據(jù)存儲在一個“廉潔”的環(huán)境中,具有所有相應(yīng)轉(zhuǎn)換和相關(guān)時間戳。另一種解決方案是內(nèi)部審計,它有助于跟蹤實施的程序、行動計劃和控制措施,以確定是否需要重新認(rèn)證或及早標(biāo)記DI 違規(guī)行為。內(nèi)部審計也將有助于在使用數(shù)據(jù)分析工具時保留DI,同樣限制訪問和不可逆的記錄方法也將有助于保留DI,特別是在需要更改規(guī)范和設(shè)置過程參數(shù)時。受監(jiān)控的連接也可用于監(jiān)控使用和跟蹤登錄,這也有助于在檢查期間跟蹤異常情況并標(biāo)記對原始數(shù)據(jù)包的違規(guī)行為。建議使用電子批次記錄或?qū)嶒炇倚畔⒐芾?LIMS) 系統(tǒng)來自動保存電子條目。此外,對記錄在便攜式平板電腦上的手動表單使用編號和受控的表格還可以幫助進(jìn)行質(zhì)量檢查,例如避免由于筆跡不佳而導(dǎo)致的信息丟失。為了滿足ALCOA+ 原則,該行業(yè)正在轉(zhuǎn)向更先進(jìn)的自主錄音系統(tǒng),例如使用數(shù)碼照片集成實驗室語音系統(tǒng)。上述解決方案很有前景,特別是因為它有助于記錄允許同時記錄數(shù)據(jù)的文檔。但是,如果不通過使用嚴(yán)格的內(nèi)部網(wǎng)共享等措施進(jìn)行適當(dāng)?shù)逆i定和控制,這些電子記錄很容易受到安全漏洞的影響。因此,在不久的將來,使用具有正確基礎(chǔ)設(shè)施、存儲服務(wù)器和相關(guān)監(jiān)管資質(zhì)的新技術(shù)可以減輕GxP 記錄中的一些 DI 風(fēng)險。
總結(jié)
遵守 DI 標(biāo)準(zhǔn)是質(zhì)量保證程序的核心部分,有助于生物制藥公司確保其產(chǎn)品的一致產(chǎn)品質(zhì)量、功效和安全性。FDA 的 ALCOA+ 指南等標(biāo)準(zhǔn)已經(jīng)發(fā)布,以幫助生物制藥行業(yè)的人員評估和減輕 DI 風(fēng)險并避免代價高昂的監(jiān)管產(chǎn)品拒絕。隨著行業(yè)向工業(yè) 4.0 轉(zhuǎn)變,DI 的重要性將變得更加重要,以實現(xiàn)依賴數(shù)字集成和數(shù)據(jù)分析的智能工廠的愿景。本文突出了研發(fā)和GMP 生產(chǎn)領(lǐng)域可能違反 DI 標(biāo)準(zhǔn)的領(lǐng)域,其中包括使用更先進(jìn)的工具,如 PAT、數(shù)據(jù)分析和云計算。本文還提出了一些緩解措施,以盡量減少和避免所討論的潛在 DI 違規(guī)行為。
(來源:生物工藝與技術(shù))