7月7日,國家藥品監督管理局藥品審評中心(CDE)組織起草了《藥物真實世界研究設計與方案框架指導原則(征求意見稿)》,指導申辦者科學合理地設計真實世界研究,明確真實世界研究方案撰寫的技術要求(征求意見時限為自發布之日起2個月)。
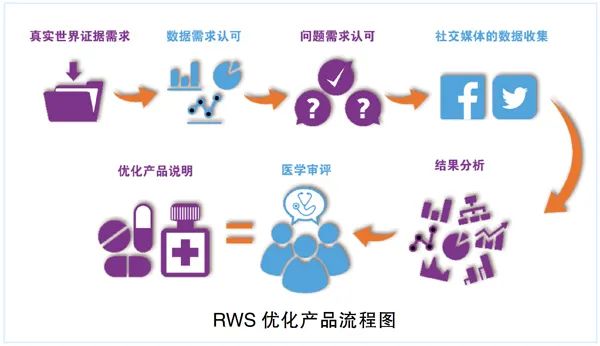
關于真實世界研究(Real World Study,RWS)的理論性文章有很多,但到實際操作層面,往往存在許多問題。最常見的問題是將RWS與用于新藥注冊上市的研究相混淆。
坑點① 自訂方案太嚴格
對策:區分上市前后研究
RWS涵蓋的范圍很廣泛,有多種多樣的研究類型,包括回顧性研究、前瞻性研究等。但是很多前瞻性RWS方案設計模仿了用于新藥注冊申報研究的設計。
例如,設計了非常嚴格的入排標準、規定了很多與研究相關的實驗室檢查和特殊檢查、規定了嚴格的訪視窗口(不許超窗)、有嚴格的關于藥品使用的規定、有嚴格的隨機程序甚至伴有盲法設計、不良事件的收集采用與注冊研究同樣的方法等等。之所以存在這樣的問題,很大程度與方案設計人員對RWS的理解存在偏差有關。
對于RWS而言,有的研究是針對疾病而非藥品進行的,例如真實世界的注冊登記(Registry)研究;有的研究是針對上市后的藥品。應該注意上市后研究和上市前研究的區別。
用于新藥注冊的藥品上市前的研究,由于藥品的療效和安全性沒有得到驗證,需要有嚴格的程序來體現藥品的療效和安全性。雖然這些嚴格的設計和程序或多或少會對受試者的權益和安全性產生影響,但是為了新藥的審批和人類健康水平的提高,經過藥監部門和倫理委員會的審查,這種影響通常被認為是值得的(對個體和社會的益處大于風險, ICH E6 R2, 2.2)。
已經上市的藥品研究其療效和安全性已經得到了確認,若仍然要求受試者服從過于嚴格的設計和程序,或者對受試者的權益造成影響,從倫理的角度就不一定能夠被接受。
坑點② 試驗目的不確切
對策:遞交IND或更佳
有的研究的目的不是很明確。例如,增加已經上市藥品的適應癥。須知,現今藥監局對臨床研究的審批速度提升,早已不是以往需要排隊兩三年的情況。企業增加已經上市藥品的適應癥完全可以通過正式遞交IND審批,做一個正規的Ⅲ期研究,這樣便不存在數據不被藥監部門認可的問題。
有的研究的目的不太正確。例如,為了刺激銷售而開展,這樣目的導向下的研究一般無法產生積極的結果。
坑點③ 試驗管理非獨特
對策:提效率嚴數量要求
有一些項目管理人員將RWS的管理與新藥注冊申報研究的管理等同起來,這樣既浪費資源,也沒有效率。RWS的項目管理計劃、監查計劃、質量管理計劃、安全性管理計劃等都具有自身的特點,不能照搬新藥注冊申報的臨床研究。
RWS對于數據質量的要求不像新藥注冊申報的研究,因為這個階段藥品的療效和安全性已經得到了確認。但是,RWS需要納入更大的樣本量、有更多的中心數量、擁有更豐富的數據量等。每個監查員管理的中心數量是新藥注冊研究的許多倍。RWS的監查員更像是臨床研究管理員,因為這類研究一般不需要做原始資料核查,中心化的遠程監查可以替代大部分現場監查,而遠程監查可以通過數據管理人員和醫學人員實施。
坑點④ 市場地位缺認可
對策:積累經驗擁抱行業
一些監查員或項目經理有一個普遍的認識誤區:做新藥注冊的研究最有含金量,做醫療器械的研究次之,而做RWS最沒有含金量。這種看法是不對的。
所有類型的研究都有各自的用處。就目前的人才市場情況來看,如果一個項目經理對RWS的管理非常有經驗,很多大數據公司都會高薪來搶人。監查員也是如此,一個能夠同時管理幾十家中心并且對各家中心的人員、機構的要求、倫理委員會的程序非常熟悉,且具備迅速解決各種問題能力的監查員,在市場上同樣熾手可熱。